Les condylomes anaux : épidémiologie, diagnostic et bilan avant traitement
1 – Les Papilloma virus humains :
Les condylomes anaux sont des lésions cutanéo-muqueuses bénignes, expression non obligatoire d’une infection locale par un papillomavirus humain (PVH) (famille des Papillomaviridae).
Au sein de cette grande famille, le genre alphapapillomavirus montre un tropisme cutanéo-muqueux chez les humains et les primates. Ce genre regroupe plus de 200 types de PVH, classés par génotype sur la base de leur séquence ADN et plus précisément selon la différence nucléotidique dans la région de la capside (L1). On distingue parmi eux deux catégories selon leur potentiel évolutif. D’une part les PVH dits à faible risque, responsables de lésions bénignes notamment les condylomes (et d’autres types de verrues, par exemple palmo-plantaires). Les génotypes 6 et 11 sont le plus fréquemment impliqués puisqu’on estime qu’ils sont responsables d’environ 90% des condylomes anogénitaux. Les PVH de type 2, 4, 7, 27, 57 et 65 sont également retrouvés. D’autre part les PVH dits à haut risque, à l’origine des lésions pré-cancéreuses ou cancéreuses. L’OMS reconnaît actuellement 12 génotypes de PVH à haut risque : 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, et 59 ; ainsi que deux génotypes supplémentaires, 68 et 73, pour lesquels la carcinogénicité́ est suspectée. Les génotypes 16 et 18 sont associés au carcinome épidermoïde de l’anus mais également au cancer du col de l’utérus, du vagin, de la vulve, du pénis et de la sphère oro-pharyngée.
2 – Contamination : combien, comment ?
La contamination sexuelle étant la plus fréquente, on considère l’infection par le PVH comme une infection sexuellement transmise (IST). A ce titre, c’est l’IST la plus fréquente au monde puisqu’on estime que 80 à 90% de la population sera un jour ou l’autre contaminée par un ou plusieurs types de PVH.
La contamination se fait par contact direct, sexuel le plus souvent ou par des objets inertes contaminés (par exemple des sex-toy… ou encore du matériel médical !). En effet, le PVH est un virus nu, il est donc relativement résistant en milieu extérieur. Les PVH sont très contagieux, la transmission d’un PVH au sein d’un couple hétérosexuel est de 20 à 40% dans les 6 premiers mois. La transmission du virus peut se faire même en l’absence de condylome visible. Cependant, la présence de condylomes augmente nettement la contagiosité, globalement on estime que les 2/3 des partenaires de personnes porteuses de condylomes en développeront à leur tour. Le risque de transmission pénis-anus serait 4 fois plus élevé que vulve-pénis.
L’efficacité du préservatif masculin pour prévenir les condylomes anaux ne semble pas très bonne.
3 – Epidémiologie :
On estime que l’incidence annuelle des condylomes ano-génitaux varie de 160 à 289/100.000 personnes (médiane de 194/100.000) avec un pic d’incidence avant 24 ans chez la femme et entre 25 et 29 ans chez l’homme puis une décroissance jusqu’à 55 ans, parallèle pour les deux localisations [1]. Ce pic est expliqué par la contamination lors des premiers rapports, la multiplicité des partenaires et le temps de portage avant clairance. L’intervalle de temps entre l’infection par un PVH de type 6 ou 11 et l’apparition des condylomes est habituellement d’environ 1 an chez les hommes et de 6 mois chez les jeunes femmes. Cependant, le virus peut parfois rester quiescent très longtemps et les condylomes n’apparaître que des années après l’infection.
Les facteurs de risque d’infection par le PVH et de condylomes sont : un âge jeune, les partenaires sexuels multiples, les rapports anaux, les rapports sexuels non protégés, une infection du partenaire par le PVH, l’immunosuppression et l’infection par le VIH, les antécédents d’IST et le tabac [1]. Le tabac apparait également comme un facteur de risque de moins bonne réponse aux traitements, et de récidive.
L’infection par un PVH au niveau anal chez la femme est souvent associée à une infection cervico-vaginale. Sans qu’on puisse l’expliquer, la concordance des génotypes n’est pas la règle entre les deux sites. Elle concerne 40% des femmes non immunodéprimées et 70% des femmes vivant avec le VIH. Chez les hommes, le portage d’un PVH au niveau anal est plus élevé chez les hommes ayant des rapports sexuels avec des hommes (HSH) vivant avec le VIH (80%), que chez les HSH négatifs pour le VIH (50%), ou chez des hommes ayant des rapports sexuels avec des femmes (HSF) VIH positifs (50%), et que chez des HSF VIH négatifs (10%) [2]. Il faut noter que la fréquence relative du génotype 16 augmente chez les hommes VIH, quelle que soit leur sexualité.
La fréquence des condylomes anaux dans la population générale est mal connue. La localisation anale est exclusive plus d’une fois sur deux chez les hommes et une fois sur trois chez les femmes. Chez les HSH les condylomes sont 2,6 fois plus fréquents au niveau anal que pénien. L’incidence des condylomes anaux est, dans une série, de 1,92/100 personnes.années [3]. Chez des patients vivant avec le VIH (n=473, HSH 42%, HSF 26%, F 32%) examinés en consultation de dépistage, la fréquence des condylomes anaux était de 23% avec une fréquence respective de 36%, 15% et 11% pour les trois groupes [4].
4 – Infection asymptomatique, clairance spontanée :
Le risque de faire une infection symptomatique est globalement faible, et serait proportionnel à la durée du portage du virus. Ainsi l’immunodépression et le tabagisme seraient des facteurs favorisants.
Au niveau cervico-vaginal, la prévalence de l’infection à PVH est élevée, mais la plupart (70-90%) sont asymptomatiques et se résolvent spontanément en l’espace de 1 à 2 ans.
Au niveau anal, le taux de clairance virale peut atteindre 90% chez la femme et 67% chez l’homme [1]. En revanche, la durée nécessaire pour parvenir à l’élimination du PVH apparaît significativement augmentée en cas d’infection par les PVH de type 16 et 18, pouvant dépasser 3 ans [1]. Cette clairance virale est liée à l’immunité anti-virale naturelle. Elle apparaît également significativement diminuée chez les patients infectés par le VIH.
Enfin, les recontaminations par d’autres génotypes sont fréquentes. Il est suggéré par certains travaux qu’une nouvelle contamination par un même génotype soit possible, mais il peut s’agir de la résurgence d’une infection latente que l’on ne sait pas toujours diagnostiquer.
Les condylomes peuvent eux aussi régresser spontanément, phénomène décrit jusqu’à chez 40% des patients.
5 – Diagnostic :
Les condylomes peuvent passer longtemps inaperçus ou encore être diagnostiqués à l’occasion d’un examen clinique de routine ou signalés par le conjoint. Les symptômes sont aspécifiques : relief inhabituel, prurit ou simple gêne, traces de sang sur le papier, ou encore difficultés d’hygiène.
Les condylomes anaux sont de diagnostic clinique. Ils se présentent sous la forme de lésions en relief, isolées ou regroupées, variables en nombre et en taille (de quelques millimètres à plusieurs centimètres), parfois fermes, mais mobiles, d’aspect le plus souvent blanchâtre, rosé ou grisâtre, de surface plus ou moins granitée, verruqueux et hyperkératosique pour la forme classique en « crêtes de coq » (Figure 1). Parfois l’aspect est moins typique : formes papuleuses, hyperpigmentées ou encore condylomes plans difficiles à individualiser. Les lésions peuvent siéger sur la marge anale mais également dans le canal anal (Figure 2).
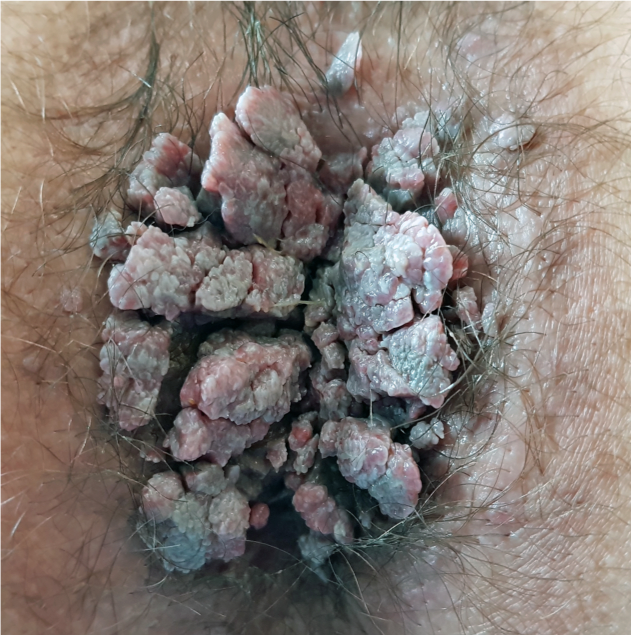
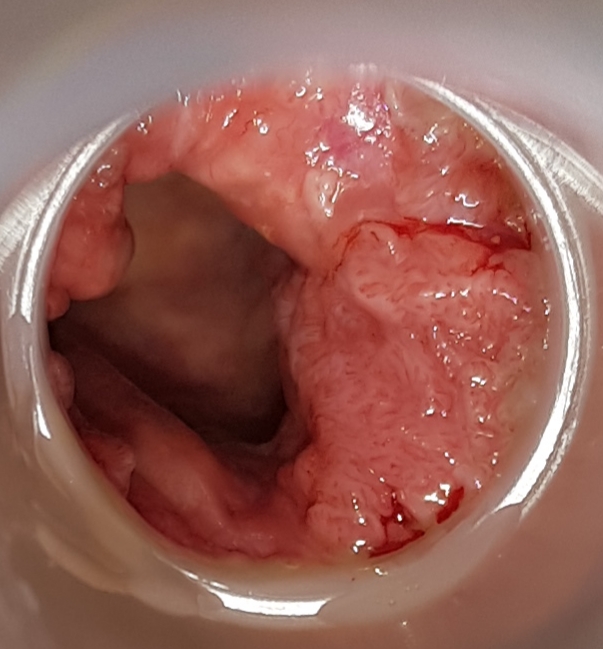
6 – Bilan initial :
Un examen anuscopique est indispensable pour rechercher une localisation canalaire. Une localisation endo anale est associée à 70% des lésions externes chez les HSH. Ni l’utilisation de colorants comme l’acide acétique, ni l’anuscopie de haute résolution ne sont recommandés pour le bilan de condylomes typiques chez un sujet non immunodéprimé.
De plus, l’anuscopie permettra d’examiner la muqueuse du bas rectum, à la recherche d’une rectite et de faire d’éventuels prélèvements locaux.
Il faut systématiquement rechercher d’autres localisations associées génitales : verge ou scrotum chez l’homme, vulve, vagin et col de l’utérus chez la femme (pour ces deux dernières localisations associées dans respectivement 15% et 6% des cas) mais aussi au niveau du pubis, et des plis inguinaux. L’examen urétral et ORL sont discutés chez les patients non immunodéprimés. L’examen des aires ganglionnaires inguinales est systématique. Les diagnostics différentiels les plus fréquents sont les lésions dermatologiques irritatives (eczéma, psoriasis), les marisques, les molluscum pendulum et contagiosum, les syphilides pouvant être très trompeuses, mais souvent suintantes. Des biopsies avec analyse histologique sont recommandées chez les sujets HSH, qu’ils soient VIH positifs ou non. En effet, la présence de condylomes anaux chez des HSH qu’ils soient VIH positifs ou non, sont associés jusqu’à 60% à une lésion dysplasique sévère. Certaines études suggèrent que ce soit un facteur de risque pour l’apparition d’un cancer anal chez ces patients. Chez HSF VIH négatifs aucune recommandation n’existe. Chez les femmes il est suggéré de faire des biopsies s’il existe un antécédent de lésion pré- ou néoplasique génitale, et en cas d’infection VIH (tableau 1). Les biopsies seront pratiquées autant sur les lésions planes qu’exophytiques, ces dernières étant souvent le siège de dysplasie. Des biopsies seront pratiquées en cas de lésion atypique, notamment ulcérée faisant craindre un processus invasif.
Afin d’éliminer une autre infection associée, certains effectuent systématiquement un écouvillonnage rectal à la recherche de gonocoque et chlamydia par PCR. De même un bilan biologique doit être proposé (VIH, syphilis, hépatites). On peut aussi proposer un examen clinique et une recherche d’autres IST chez le partenaire.
Points clés
L’infection par le PVH est l’infection sexuellement transmissible la plus fréquente au mondeEn Europe, les PVH de type 6 et 11 sont responsables de la majorité (environ 90%) des condylomes ano-génitaux. La fréquence de l’infection à PVH au niveau anal est élevée chez les HSH vivant avec le VIH (80%), moindre chez les HSH VIH- (50%), et chez les HSF VIH- (10%). Chez les femmes elle est de 70% si VIH+, et 40% chez les VIH-.L’intervalle de temps entre l’infection par un PVH de type 6 ou 11 et l’apparition de condylomes ano-génitaux est habituellement d’environ 1 an chez les hommes et de 6 mois chez les jeunes femmes, mais le virus peut rester quiescent des années.Les principaux facteurs de risque pour une condylomatose anale sont : les partenaires sexuels multiples, les rapports anaux, les rapports sexuels non protégés, une infection du partenaire par le PVH, les antécédents d’IST, une infection à PVH génitale, l’infection par le VIH, l’immunosuppression et le tabacLe diagnostic de condylomes est clinique. La biopsie est indiquée en cas de doute diagnostic, ou pour rechercher une lésion pré-cancéreuse ou cancéreuse chez les sujets à risque et devant un aspect atypique.Le bilan initial doit éliminer une autre IST associée.
Imiquimod et condylomes de la marge anale et péri-anaux
1 – Mode d’action
Son action est principalement locale, et limitée au point d’application. L’imiquimod est un traitement immunomodulateur qui va stimuler la réponse immunitaire innée et acquise. C’est un agoniste des récepteurs TLR-7 (Toll-Like Receptor). Il induit la sécrétion, par les cellules dendritiques, de cytokines pro-inflammatoires (TNF-alpha, interféron-alpha, IL1, 6, 8 et 12) entraînant l’activation des lymphocytes T et des cellules NK (Natural Killer) qui vont détruire les cellules infectées par le PVH [5]. Par le même mécanisme, il stimule également l’immunité servant à la destruction des cellules néoplasiques cutanées et possède donc une indication dans le traitement des carcinomes baso-cellulaires superficiels.
L’imiquimod favoriserait également la clairance du virus.
2 – Utilisation
Ce produit fait partie des traitements auto appliqués. Cet élément est à prendre en compte dans l’élaboration de la stratégie thérapeutique avec le patient. Il s’agit d’une crème dont seule la concentration à 5% est disponible en France (une formulation à 3,75% est disponible aux Etats-Unis). Elle est appliquée par le patient 3 fois par semaine sur les condylomes, le soir au coucher en massant jusqu’à pénétration complète du produit, pour une durée maximale de 16 semaines consécutives selon l’AMM [5]. Il est important de bien nettoyer les mains après application et de nettoyer dès le lendemain matin la zone traitée pour limiter les effets indésirables, la durée de contact devant être comprise entre 6 et 10 heures [5].
Il est classique d’attendre 3 mois après l’apparition des éléments avant de démarrer un traitement, car dans environ 30 à 40% des cas les condylomes régressent spontanément en l’absence de traitement. Cependant leur évolution reste imprévisible et il n’est pas possible de prédire quelles lésions vont involuer, rester stables ou au contraire croître avec le temps. D’autre part, les condylomes induisent une gêne et une anxiété importantes pour le patient. Dès lors, il est licite de les traiter dès la première consultation, qui survient en général plusieurs semaines après l’apparition des premiers éléments.
3 – Efficacité
L’objectif du traitement est de détruire les condylomes afin d’éviter l’extension des lésions et limiter la contagiosité. L’amélioration de la qualité de vie est une priorité du traitement. La notion de satisfaction envers le traitement est aussi un élément essentiel à prendre en compte, car le choix des thérapeutiques est large et aucun algorithme n’existe. [6].
L’imiquimod a obtenu l’AMM en France pour le traitement des condylomes anogénitaux externes, et une récente méta-analyse a confirmé son efficacité dans cette indication [7]. Logiquement l’imiquimod a une moins bonne efficacité primaire par rapport aux techniques de destruction, mais le risque de récidive à moyen terme serait soit équivalent [8, 9], soit moindre qu’avec les autres traitements [10].
Les taux de guérison (après 12 à 16 semaines d’application) varient selon les études entre 35 et 75%, supérieurs au placebo. Le temps médian pour obtenir la disparition des lésions est compris entre 7 et 12 semaines. Les patients doivent être informés du délai d’action parfois long afin d’éviter un arrêt trop précoce.
Aucune donnée n’est disponible sur l’éventuelle influence du nombre, de l’aspect ou de la taille des lésions sur l’efficacité du traitement. On considère que les applications quotidiennes n’apportent pas d’avantage par rapport au schéma recommandé de trois applications par semaine effectuées à des jours non consécutifs.
Son efficacité a été comparée aux autres traitements chez les patients non immunodéprimés dans deux travaux récapitulatifs récents de la même équipe [8, 10], et dans toutes les populations dans une autre analyse de la littérature [9]. L’analyse statistique en réseau des différents résultats montre que les traitements effectués par un soignant (chirurgie, cryothérapie, acide trichloroacétique 80% (topique appliqué par le praticien une fois par semaine pendant 3 semaines)) ont une meilleure efficacité en fin de traitement [9], et à 6 mois [8] par rapport aux traitements appliqués par le patient (imiquimod, sinécatéchines, podophyllotoxine 0,5% (un traitement cytolytique, utilisé en auto-application 3 jours par semaine pendant 4 semaines) [8]. L’analyse poolée montre elle aussi une meilleure efficacité immédiate des traitements destructeurs, mais un taux de récidive à 12 mois inférieur après les traitements auto administrés, dont fait partie l’imiquimod [10].
Le taux de récidive après un traitement efficace par imiquimod serait faible, entre 6 et 19% [5]. On manque d’études contrôlées comparant directement l’imiquimod aux autres traitements. Les études disponibles, incluant de faibles effectifs avec des risques de biais importants, peuvent rapporter un taux de récidive plus bas qu’après podophyllotoxine, acide trichloroacétique ou les autres techniques de destruction.
L’imiquimod serait moins efficace chez les patients infectés par le VIH par rapport aux sujets immuno-compétents, les taux de réponse complète pouvant être divisés par deux, vraisemblablement du fait d’une moins bonne réponse immunitaire.
Chez la femme enceinte, selon le CRAT, les techniques de destruction et l’application d’acide trichloracétique ou de podophyllotoxine, doivent être préférées à l’imiquimod (lecrat.fr).
4 – Effets indésirables
Les principaux effets secondaires sont locaux, avec la survenue de douleurs en lien avec une dermite plus ou moins sévère, au maximum ulcérée (témoignant de la réponse immunitaire), pouvant aboutir à l’interruption du traitement. Une dépigmentation (vitiligo induit) est possible mais plus rare. Dans l’étude multicentrique de Garland et al. (943 patients), 13% des patients ont présenté des douleurs/irritations, 11% un prurit et 6% des brûlures. Ces réactions cutanées locales étaient fréquentes puisque 2 patients sur 3 ont présenté un érythème aux points d’application. Les auteurs ont observé une diminution de la fréquence des effets secondaires en cas de second traitement (pour une récidive) ou au cours du temps lors de traitements prolongés du fait d’une réponse initiale partielle [11].
Il faut noter qu’en dépit de réactions cutanées locales fréquentes, la tolérance et l‘acceptabilité sont jugées bonnes par les patients, supérieures aux techniques de destruction, à la podophyllotoxine et à l’acide trichloroacétique. Afin d’améliorer la tolérance et limiter les interruptions de traitement, on peut proposer un topique cicatrisant en pommade à appliquer en alternance avec l’imiquimod ou encore d’espacer transitoirement les applications.
Points clés
L’imiquimod est un traitement immunomodulateur validé pour les condylomes de la marge anale et péri-anaux.Son efficacité varie entre 35 et 75% (disparition complète des lésions).Il est moins efficace à court terme que les techniques de destruction mais le risque de récidive serait équivalent ou inférieur à moyen terme.Les effets secondaires sont fréquents : érythème, douleurs, brûlures/irritations, prurit et saignements. Le patient doit en être informé.Ils sont pour la plupart bien tolérés et résolutifs à l’arrêt du traitement (sauf vitiligo induit).L’auto application d’imiquimod reste un des traitements les mieux acceptés par les patients.
Imiquimod et condylomes endocanalaires : une possibilité hors AMM ?
L’imiquimod a obtenu une AMM pour les verrues génitales et périanales externes. Il n’est théoriquement pas indiqué pour traiter les condylomes endocanalaires. Or les lésions canalaires sont fréquentes (présentes plus d’une fois sur quatre en cas de lésions externes chez les HSH, et isolées dans 30% des cas dans cette même population). L’imiquimod appliqué sur la marge anale n’a jamais démontré son efficacité sur les lésions à distance, notamment celles associées au niveau canalaire.
La littérature est pauvre, depuis le début des années 2000 seuls quelques travaux ont évalué son utilisation dans cette indication. Différentes galéniques ont été utilisées : crème, suppositoires et tampons.
Une récente revue de la littérature a évalué l’efficacité et la tolérance de l’imiquimod utilisé en endocanalaire, pour le traitement des condylomes, mais également des lésions dysplasiques de haut grade [12]. Au total, 14 études incluant 422 patients ont été retenues pour l’analyse. Aucune série n’était une étude contrôlée. Les patients étaient majoritairement des hommes (70%) et des patients infectés par le VIH (66,6%). La moitié des patients présentait des lésions de dysplasie de haut grade et 45% des condylomes. L’imiquimod était appliqué durant 15 semaines en moyenne. Dans 84% des cas la galénique utilisée était de la crème auto appliquée dans le canal anal. Dans le groupe de patients traités pour des condylomes, 67% des patients étaient considérés guéris au terme du traitement, un taux similaire à celui retrouvé dans le traitement des lésions péri-anales. Le taux de récidive était de près de 20% sur un suivi moyen de 16,4 mois. Les principaux effets secondaires rapportés étaient : douleurs (10%), suintements (6%), brûlures (5%), saignements (4%), irritations et érythème (3 et 3%), syndrome pseudo-grippal (2%) et dermite ulcérée (1%). Ces complications étaient pour la plupart résolutives à l’arrêt du traitement et aucune complication jugée grave n’a été rapportée. Ces effets secondaires ne sont pas spécifiques à l’application de l’imiquimod dans le canal anal et s’observent également en cas d’application sur la marge anale. Toutefois, le syndrome pseudo-grippal (lié à l’activation immunitaire) serait favorisé par l’absorption de l’imiquimod par la muqueuse rectale. Ainsi les auteurs recommandaient de ne pas appliquer l’imiquimod au-delà de la ligne pectinée. D’aucuns ont également proposé l’utilisation de suppositoires centrés par une gaze afin de les retenir dans le canal anal.
Aussi, l’application intravaginale n’est pas recommandée de crainte de complication à type de sténose urétrale. De telles complications n’ont pas été décrites concernant le canal anal. A contrario, elles sont une complication possible des techniques de destruction ou d’exérèse en cas de lésions étendues.
Malgré ces bons résultats, plusieurs limites incitent à une interprétation prudente. Tout d’abord, le faible effectif de patients traités pour des condylomes (n=191) et l’hétérogénéité des populations étudiées (proportion importante de patients infectés par le VIH entre autres) qui limitent la généralisation des résultats. Par ailleurs, le niveau de preuve reste faible en raison des faiblesses méthodologiques des travaux cités (aucune étude randomisée contrôlée). Enfin, dans plusieurs travaux, l’imiquimod était associé au traitement ablatif (laser), ne permettant pas de conclure formellement à l’efficacité de l’imiquimod en monothérapie dans cette indication.
Depuis cette revue de la littérature, une seule étude ouverte supplémentaire, incluant 95 patients vivants avec le VIH traités pour des condylomes ou des lésions dysplasiques intra-canalaires, a montré une efficacité complète ou partielle des suppositoires dans 47% des cas en intention de traiter. Les effets indésirables étaient acceptables dans 80% des cas. A noter, 20% d’effets systémiques du traitement [13].
Cette indication souffre d’un niveau de preuve limité à ce jour, de la difficulté à concevoir la galénique idéale qui permettrait une application de produit en quantité suffisante, sans déborder de façon importante sur la muqueuse rectale, bien que sa sécurité d’emploi ne semble pas remise en cause dans cette localisation.
Elle représente toutefois une alternative intéressante pour les localisations canalaires qui sinon, relèvent d’emblée de techniques destructrices. En cas de lésions associées, la combinaison imiquimod pour les lésions externes/destruction des lésions internes n’a elle non plus fait l’objet d’aucune étude.
Ainsi, l’utilisation de l’imiquimod pour le traitement des condylomes du canal anal ne peut être officiellement recommandée car elle reste hors AMM. Elle est toutefois mentionnée dans les recommandations européennes avec la même réserve [6].
Points clés
L’imiquimod serait efficace pour le traitement des condylomes du canal anal et permettrait de guérir environ 2 patients sur 3.L’auto application de crème a été la plus étudiée, même si d’autres galéniques sont envisagées.Elle serait une alternative aux méthodes de destruction, seules proposées pour cette localisation.Les types et la fréquence des effets secondaires sont proches de ceux observés en cas d’application externe ; à l’exception peut-être des réactions systémiques favorisées par l’absorption de l’imiquimod par la muqueuse rectale.Le niveau de preuve reste cependant faible.Des études dédiées sont nécessaires afin de valider son utilisation (hors AMM) dans cette indication.
Imiquimod en combinaison : en adjuvant des techniques de destruction ? en association avec le vaccin ?
1 – Les techniques de destruction physique
Les techniques de destruction (ou ablatives) ont l’avantage d’avoir une efficacité élevée immédiate et à court terme. Parmi ces techniques, les plus répandues sont l’exérèse chirurgicale, l’électrocoagulation au bistouri électrique, le laser CO2 et Nd YAG, l’azote, ou encore la photocoagulation infrarouge.
Toutefois, outre leur morbidité spécifique (douleurs, saignements, sténose, risque d’incontinence anale et de troubles de la sexualité anale en cas de lésions étendues), elles sont associées à un risque élevé de récidive, jusqu’à 77% pour le laser par exemple, supérieur à l’imiquimod [5]. Le risque de récidive s’explique notamment par le fait que ces techniques traitent uniquement les lésions visibles et non l’infection à PVH [5, 14].
2 – Efficacité de l’imiquimod en péri-opératoire
Plusieurs travaux ont suggéré que l’utilisation d’un traitement immunomodulateur après traitement par des techniques ablatives permettait de réduire le risque de récidive. Le traitement est habituellement débuté 2 à 3 semaines après la destruction des lésions afin de respecter un délai de cicatrisation. Une étude ouverte, randomisée contrôlée, incluant 358 patients, a comparé 3 groupes de patients : un groupe traité par technique ablative seule (électrocoagulation, exérèse, laser ou azote), un groupe traité par une technique ablative associée à un traitement post-opératoire par imiquimod 5% (3 fois/semaine durant 3 mois) et un groupe imiquimod seul. A 6 mois, le taux de récidive était significativement diminué dans le groupe traitement ablatif plus imiquimod versus traitement ablatif seul (8% vs 26% p<0,004). En revanche le risque de récidive était similaire par rapport à l’imiquimod seul (6%) [15].
Plus récemment, les données issues d’une revue systématique de la littérature incluant 37 études randomisées contrôlées, ont suggéré que l’utilisation de l’imiquimod 5% en post-opératoire précoce améliorait les taux d’efficacité après laser CO2 (RR=1,53 à 3 mois et 1,9 à 6 mois) et électrocoagulation (RR=1,62 à 6 mois) [16]. Le taux de complication n’était pas rapporté. Toutefois, il n’y avait pas de différence significative entre les groupes. Les principaux effets secondaires étaient considérés de gravité faible à modérée (érythème, brûlures, suintements, douleurs, érosions et ulcérations) et résolutifs spontanément ou après interruption du traitement.
Outre les faiblesses méthodologiques de certaines études prises en compte dans l’analyse, une des principales limites à ce travail était l’absence de données spécifiques concernant les patients immunodéprimés, particulièrement à haut risque de récidive.
Enfin, l’imiquimod pourrait également avoir un intérêt en pré-opératoire. D’une part, il permettrait de diminuer l’étendue des lésions et faciliter ainsi le geste chirurgical. D’autre part, la stimulation pré-opératoire de la réponse immunitaire réduirait le risque de récidive post-opératoire par rapport à la chirurgie seule.
Ainsi, l’utilisation de l’imiquimod en péri-opératoire apparaît pertinente pour diminuer le risque de récidive des condylomes. Les dernières recommandations de la société européenne de dermatologie ont d’ailleurs validé l’utilisation de l’imiquimod dans cette indication [5].
3 – Vaccin contre le HPV au cours d’un traitement ?
Certains indices (case reports, analyse de sous-groupe d’un essai sur le vaccin PVH montrant un moindre risque de récidive chez les femmes en cours de traitement pour des condylomes si elles étaient incluses dans le bras vaccin) pourraient faire supposer que vacciner un patient en cours de traitement pour des condylomes pourrait augmenter ses chances de guérison et diminuer le risque de récidive. A ce jour, un seul essai contrôlé a essayé de répondre à cette question. Il a inclus 503 patients (66% hommes, 2,4% VIH+) traités pour des condylomes ano-génitaux dans quatre bras : imiquimod seul, podophyllotoxine seule, combinaisons avec le vaccin quadrivalent. De la cryothérapie était possible à partir de 4 semaines de traitement. Sur l’objectif principal qui était la guérison à 16 semaines, et le maintien sans récidive jusqu’à la semaine 48, le type de traitement local n’était pas significativement influent (imiquimod vs podophyllotoxine OR 0,81 (95% CI 0,54 – 1,23)), et l’association au vaccin était à la limite du significatif OR 0,46 (95% CI 0,97 – 2,20) [16].
A ce jour, aucun élément n’incite à proposer la vaccination contre le PVH en adjuvant à un traitement local dans un but thérapeutique. Toutefois le vaccin contre le PVH reste essentiel à proposer, même chez un patient porteur de condylomes, pour le protéger d’une infection par un autre PVH. Les populations auxquelles proposer ce vaccin incluent les filles et les garçons de 11 à 14 ans avec rattrapage possible jusqu’à 19 ans, et les HSH jusqu’à 26 ans.
Points clés
Malgré une littérature encore discutable, des éléments soutiennent une prescription combinée avec les techniques de destruction.L’imiquimod, utilisé précocement en post-opératoire, permet de diminuer de plus de 50% le risque de récidive après une technique de destruction. La tolérance du traitement est bonne.L’imiquimod a également un intérêt en pré-opératoire pour diminuer l’étendue des lésions. La stimulation immunitaire réduirait également le risque de récidives.L’utilisation du vaccin en adjuvant des traitements locaux n’a pas démontré son intérêt. Toutefois la vaccination reste importante à proposer chez ces patients à titre préventif d’une autre infection à PVH.
Imiquimod et HSIL : une indication ?
1 – Formes cliniques
Comme décrit précédemment, l’infection à PVH au niveau de l’anus revêt principalement deux formes cliniques : les condylomes acuminés et les condylomes plans. Les condylomes plans peuvent siéger au niveau de la marge anale mais sont plutôt endocanalaires et peuvent être difficiles à repérer macroscopiquement. Ils sont associés aux PVH oncogènes et sont plus souvent le siège d’une dysplasie. L’extension de la dysplasie peut être importante parfois jusqu’à atteindre la quasi-totalité de la circonférence de la marge anale ou du canal anal. Il existe une autre entité clinique appelée maladie de Bowen. La maladie de Bowen est une affection dermatologique péri-anale ou vulvaire liée aux PVH oncogènes à type de placard aux limites nettes, aux aspects cliniques polymorphes : forme érythémateuse, blanchâtre ou rosée. Histologiquement, il s’agit d’une lésion en dysplasie de haut grade qui peut être associée à des foyers d’invasion.
2 – Définition et classification
- Classification cytologique selon Besthesda déterminée d’après l’analyse d’un frottis anal : lésions de dysplasie de bas grade ou LSIL (Low grade Squamous Intraepithelial Lesion), lésions de dysplasie de haut grade ou HSIL (High grade Squamous Intraepithelial Lesion), lésions de signification indéterminée ou ASCUS (Atypical Squamous Cell of Undetermined Significance)
- Classification histologique déterminée d’après l’analyse d’une biopsie avec analyse de la dysplasie : AIN (anal intra epithelial neoplasia). On distingue les lésions de dysplasie anale de bas grade ou AIN 1 et 2 p16 négatif, et les lésions de dysplasie anale de haut grade ou AIN 2 p16 positif et AIN 3. La nouvelle terminologie dérivée de celle appliquée à la cytologie regroupe les condylomes, les condylomes sans dysplasie et les AIN1 en LSIL, les AIN2 et 3 en HSIL.
3 – Epidémiologie, facteurs de risque et histoire naturelle
Les lésions de dysplasie anale de haut grade, HSIL pour (High grade Squamous Intraepithelial Lesion) sont des lésions viro-induites secondaires à une infection persistante par un ou plusieurs PVH à haut risque, principalement les types 16 et 18. On observe presque toujours des stigmates d’infection virale par le PVH sur les biopsies.
La plupart des données analysant les facteurs de risque des dysplasies différencient les patients selon l’infection par le VIH. Les prévalences des lésions de haut grade chez les principaux groupes à risque sont résumées dans le tableau 2. Les hommes infectés par le VIH et ayant des rapports sexuels anaux avec des hommes (HSH) sont le principal groupe à risque avec une prévalence des HSIL de près de 30% [17]. Les autres groupes à risques sont les patients HSF et les femmes infectées par le VIH, les patients HSH non VIH, les patients greffés, les patients sous immunosuppresseurs et les femmes avec un antécédent de dysplasie de haut grade ou de cancer invasif du col utérin. La prévalence des lésions HSIL au niveau de l’anus est estimée à 21,5% chez les HSH non VIH, environ 13% chez les femmes infectées par le VIH, 8% chez les femmes ayant un antécédent de dysplasie de haut grade ou de cancer du col de l’utérus, 5% chez les patients transplantés. Les localisations sus-pectinéales sont plus souvent en dysplasie que celles de la marge. Chez les patients séropositifs pour le VIH, si les traitements antirétroviraux puissants actuellement disponibles augmentent la survie des patients, ils ne semblent pas diminuer significativement l’incidence des lésions anales de haut grade.
Ces lésions sont considérées comme des lésions pré-cancéreuses, précurseurs du carcinome épidermoïde de l’anus. Le risque de développer un cancer de l’anus lorsqu’on est porteur d’une lésion HSIL n’est pas connu avec exactitude. Il varie de 1 à 10% à 5 ans selon les études. Par ailleurs, des travaux récents ont révélé que les lésions HSIL peuvent aussi régresser dans environ un tiers des cas. Le devenir des lésions HSIL, et les facteurs favorisant sa progression ou sa régression, sont mal connus. Plusieurs cohortes sont en cours pour tenter de répondre à ces questions (cohorte AIN3 du GREP et de la SNFCP et cohorte APACHES de l’Agence Nationale de Recherche sur le Sida).
La récidive des lésions de dysplasie de haut grade après traitement est fréquente. Ainsi dans une étude rétrospective chez 727 patients HSH (VIH ou non), Goldstone et al retrouvaient un taux de récidive après traitement respectivement de 53 et 49% à un an, 77 et 66% à 3 ans [18].
4 – Dépistage
Le dépistage des populations à haut risque de développer des lésions de dysplasie de haut grade (tableau 3) nécessite un examen proctologique régulier et minutieux avec anuscopie et biopsie systématique de toute lésion suspecte. Les lésions de dysplasie peuvent être invisibles à l’œil nu et par conséquent difficiles à repérer macroscopiquement. L’anuscopie haute résolution (AHR) est un outil qui permet de détecter les lésions de dysplasie microscopiques non visibles à l’œil nu mais il n’est actuellement pas démontré que le dépistage et la prise en charge précoce des lésions de haut grade avec cytologie de triage et AHR diminuent la mortalité par cancer du canal anal. La réalisation d’un frottis anal suivi d’une AHR en cas de frottis pathologique en pratique courante dans la cadre du dépistage et de la surveillance des patients à risque est très débattue à ce jour. Les seules recommandations françaises de dépistage qui existent actuellement ne concernent que les patients infectés par le VIH (HSH, tout patient avec un antécédent de condylomes ano-génitaux et les femmes avec un antécédent de dysplasie ou de cancer du col de l’utérus) (rapport Morlat 2017) : dépistage annuel par un examen proctologique associant un examen de la marge anale, un toucher rectal et une anuscopie standard.
5 – Stratégies thérapeutiques et enjeux
Il est recommandé de traiter les lésions HSIL dans le but de prévenir la survenue d’un carcinome épidermoïde du canal anal ou de la marge anale. Néanmoins à ce jour, le bénéfice d’une telle stratégie sur l’incidence du cancer de l’anus n’a pas été démontré. Plusieurs traitements sont validés que l’on peut schématiquement classer en deux catégories. D’une part les traitements topiques, dont l’imiquimod fait partie, mais également le 5-fluorouracil (5-FU), l’acide trichloroacétique, ou encore le cidofovir (antiviral non disponible en France dans cette indication). D’autre part les techniques de destruction déjà abordées, qui comprennent l’exérèse chirurgicale et l’électrocoagulation au bistouri électrique mais également, la photocoagulation infrarouge, la cryothérapie ou encore le laser.
Les traitements ablatifs apparaissent globalement supérieurs aux traitements topiques en termes d’efficacité mais le risque de récidive est élevé et ils exposent à un risque de complications sévères particulièrement en cas de lésions étendues ou de traitements itératifs (retard de cicatrisation, sténose anale, incontinence anale, etc.) pouvant être à l’origine d’une altération majeure de la qualité de vie. L’objectif est d’arriver à traiter les lésions en limitant au maximum la morbidité et les séquelles fonctionnelles.
6 – Place et limites de l’imiquimod
Depuis le milieu des années 2000, plusieurs travaux ont évalué la tolérance de l’imiquimod et son efficacité pour le traitement des HSIL. Une première étude pilote prospective ouverte, incluant 28 patients HSH infectés par le VIH, a montré parmi les 22 patients compliants une disparition clinique et histologique des lésions de néoplasie intraépithéliale de la marge et du canal anal (AIN1 à 3) chez 77% des patients traités par imiquimod après 16 semaines de traitement [19]. Ce résultat était maintenu chez 78 % des répondeurs après 5 mois de suivi. Cette réponse était associée à une réduction significative du taux d’ADN PVH et du nombre de type de PVH, mais rarement à la disparition du virus. En 2007, Kreuter et al. ont mis en évidence une diminution de la protéine p16 (protéine impliquée dans la dérégulation du cycle cellulaire présente en cas d’infection par un PVH à haut-risque) et de l’ADN viral au sein de lésions de haut grade chez les patients traités par imiquimod [20].
Par la suite, un essai randomisé contrôlé contre placebo a montré la supériorité de l’imiquimod (n=28) sur le placebo (n=25) avec un taux de régression des lésions de haut grade de 43% contre 4% [21]. Parmi les 12 patients ayant répondu au traitement, 4 ont montré une régression complète des lésions et 8 patients une régression vers des lésions de dysplasie de bas grade. Un autre essai randomisé contrôlé a comparé l’imiquimod, le 5-fluorouracil (5-FU) et l’électrocoagulation au bistouri électrique chez des patients HSH infectés par le VIH. Dans le groupe traité par imiquimod (n=54), le taux de réponse complète était de 24% tandis que 11% des patients avaient une régression partielle des lésions (régression du degré de dysplasie). L’électrocoagulation apparaissait comme le traitement le plus efficace avec un taux de réponse complète de 39% (p=0,027). En revanche, quel que soit le traitement (imiquimod, 5-FU ou électrocoagulation), le taux de récidive était élevé sans différence significative entre les groupes, 22% à 6 mois et 46% à 1 an. Les effets secondaires étaient fréquents (plus de 90% des patients) et l’imiquimod a été interrompu chez 5 patients. Les principaux effets rapportés étaient : douleurs (70%), saignements (30%), prurit (19%) et syndrome pseudo-grippal (13%, spécifique au traitement par imiquimod). Les taux d’effets secondaires ne différaient pas entre les traitements. En revanche, les auteurs ont observé plus fréquemment des effets secondaires considérés comme modérés à sévères (grade 3 et 4) avec l’imiquimod (43%) par rapport au 5-FU (27%) et à l’électrocoagulation (18%)[22].
Deux revues de la littérature récentes permettent de faire une synthèse des résultats de l’imiquimod pour le traitement des HSIL [12, 23]. Il s’agit, pour tous les travaux, de traitements avec une « posologie standard » (imiquimod 5% 3 fois par semaine), et de longue durée (16 semaines). Dans le travail de Brogden et al., 5 études ont été incluses soit 164 patients [23]. Il s’agissait exclusivement d’HSH infectés par le VIH. Les taux de réponse complète variaient de 14 à 86%, et 5 à 35% des patients traités ont présenté une réponse partielle (régression du degré de dysplasie). Les effets secondaires étaient fréquents (douleurs, irritations, saignements) cependant la compliance était jugée bonne, entre 79 et 100% selon les études. Enfin, dans le travail de Gkegkes et al. dédié aux études ayant évalué l’application intra-anale incluant 422 patients (66% VIH) avec des lésions HSIL, une guérison complète était observée chez 35% des patients et une réponse partielle chez 21%. Le taux de récidive était de 15% (suivi moyen de 16,4 mois). Le traitement était pour 55% appliqué sous forme de crème, et la durée le plus souvent de 16 semaines [12].
7 – Quand proposer un traitement par imiquimod ?
A l’instar du traitement des condylomes endocanalaires, l’imiquimod n’a pas l’AMM pour le traitement des HSIL. Il s’avère cependant être un traitement efficace des lésions de dysplasie de haut grade de la marge anale et du canal anal et il semble licite de le proposer aux patients dans l’arsenal thérapeutique pour le traitement des lésions HSIL de la marge anale ou du canal anal peu étendues. Il pourrait s’avérer également particulièrement intéressant en cas de lésions étendues pour lesquelles l’exérèse chirurgicale et l’électrocoagulation ne seraient pas possibles ou à haut risque de séquelles, dans l’espoir de réduire la taille des lésions et diminuer ainsi la morbidité des techniques ablatives. Le niveau de preuve reste toutefois faible et comme pour le traitement des condylomes « simples », les effets secondaires sont fréquents et parfois invalidants. Le patient doit en être informé d’autant qu’il est souvent nécessaire de réitérer le traitement. En effet, le risque de récidive est élevé. Une surveillance étroite et prolongée des patients est nécessaire.
Points clés
Les lésions HSIL sont des lésions précancéreuses.Il semble recommandé de les traiter pour éviter la survenue d’un carcinome épidermoïde de l’anus.Les techniques ablatives sont efficaces mais peuvent être à l’origine de séquelles fonctionnelles.L’imiquimod permettrait une régression complète des lésions HSIL chez environ 1 patient sur 3 à 4. Le taux de guérison immédiat est inférieur aux techniques de destruction.Les effets secondaires sont fréquents mais la compliance reste élevée dans les études.Le risque de récidive est important, jusqu’à 50% à 1 an.Une surveillance étroite et prolongée des patients est nécessaire.
Quelle surveillance après un traitement efficace ?
On peut individualiser deux situations : 1) les patients présentant des condylomes sans autre facteur de risque de cancer de l’anus, 2) les patients à risque de lésions pré-cancéreuses et de cancer de l’anus.
Chez les patients sans facteur de risque, l’objectif de la surveillance après traitement est avant tout de dépister précocement les récidives pour les traiter et ainsi limiter l’extension des lésions et la contagiosité. La surveillance est clinique, par un examen proctologique standard. Il n’existe à ce jour aucune recommandation concernant la surveillance des patients traités pour des condylomes, aussi bien pour la durée que pour la périodicité des contrôles. Le délai d’action de l’imiquimod pouvant atteindre plusieurs semaines, un premier contrôle peut être proposé 4 à 8 semaines après l’initiation du traitement puis à la fin du traitement afin d’apprécier l’efficacité et la tolérance. Même si le risque de récidive est mal connu dans les populations non VIH et non HSH, on peut le considérer comme globalement élevé, au moins à court terme. Une surveillance rapprochée semble licite initialement. La surveillance sera progressivement espacée en l’absence de récidive, par exemple doublement de l’intervalle entre deux consultations au cours de la première année. Par la suite, elle peut raisonnablement être interrompue, en accord avec le patient et en insistant sur la nécessité de consulter en cas de symptômes proctologiques.
Chez les patients avec des facteurs de risque, l’objectif de la surveillance est de dépister les lésions pré-cancéreuses afin de les traiter et ainsi éviter la survenue d’un cancer invasif. Un objectif plus modeste est de dépister le cancer à un stade précoce, gage d’un meilleur pronostic. Une surveillance au long cours est recommandée même si le bénéfice des stratégies de dépistage sur la survenue du cancer de l’anus n’a pas été démontré à ce jour. Les recommandations françaises ne concernent que les patients infectés par le VIH. Les modalités du dépistage prêtent à débat et en France l’examen proctologique standard annuel reste recommandé en première intention. Compte-tenu de la faible sensibilité de l’examen clinique pour le dépistage des lésions pré-cancéreuses, la plupart des recommandations internationales préconisent en plus du toucher rectal, la réalisation d’un frottis anal (examen cytologique), éventuellement associé à la recherche d’une infection par un PVH à haut risque. En cas d’anomalies à l’un de ces examens, une anuscopie haute résolution est recommandée. Ensuite, les modalités du suivi sont fonction des résultats et ne seront pas abordés ici.
Conclusion
L’imiquimod est un traitement validé des condylomes ano-génitaux externes. Il apparaît globalement moins efficace que les techniques de destruction. Mais par son action immunomodulatrice il diminue le risque de récidive, aussi bien en monothérapie qu’en association aux techniques de destruction. Les effets secondaires mineurs sont fréquents mais pour la plupart résolutifs à l’arrêt du traitement. C’est un avantage par rapport aux techniques de destruction dont la morbidité n’est pas négligeable (et inacceptable pour une pathologie bénigne) particulièrement en cas de lésions étendues. L’imiquimod a également montré son efficacité pour le traitement des HSIL. Le risque de récidive est cependant élevé dans cette situation et impose une surveillance au long cours des patients. En revanche, les données sont plus limitées concernant le traitement des condylomes du canal anal.
| Lésion de présentation atypique (pigmentée, plane, ulcérée) Lésion récidivante Hommes ayant des rapports sexuels avec des hommes (HSH) Immunosuppression acquise ou innée (infection par le VIH, traitement immunosuppresseur, déficit immunitaire, etc.) Antécédent de dysplasie de haut grade anogénitale |
| Population à risque | Prévalence lésions de haut grade |
| HSH* infectés par le VIH | 29,1% |
| HSH* | 5 à 21,5% |
| Femmes infectées par le VIH | 12,9% |
| Femmes avec un antécédent de lésion de dysplasie de haut grade ou de cancer génital | 8% |
| Patients atteints d’une maladie inflammatoire chronique intestinale | 8,7% |
| Patients transplantés | 5% |
*Hommes ayant des rapports Sexuels avec des Hommes
| Patients VIH+ : HSH, antécédent de condylomes/dysplasie ano-génitaux Femmes ayant un antécédent de lésion de dysplasie de haut grade ou de cancer cervico-vulvo-vaginal |
| Patients immunodéprimés (transplantés d’organe, déficit immunitaire, maladie auto-immune, etc.) |
HSH, Hommes ayant des rapports Sexuels avec des Hommes
Bibliographie
- Taylor S, Bunge E, Bakker M, Castellsagué X. The incidence, clearance and persistence of non-cervical human papillomavirus infections: a systematic review of the literature. BMC Infect Dis 2016;16:293.
- Marra E, Lin C, Clifford GM. Type-Specific Anal Human Papillomavirus Prevalence Among Men, According to Sexual Preference and HIV Status: A Systematic Literature Review and Meta-Analysis. J Inf Dis 2019;219:590–598.
- Jin F, Prestage GP, Kippax SC, Pell CM, Donovan B, Templeton DJ, Kaldor JM, Grulich AE. Risk factors for genital and anal warts in a prospective cohort of HIV-negative homosexual men: the HIM study. Sex Transm Dis 2007;34:488-93.
- Abramowitz L, Benabderrahmane D, Ravaud P, Walker F, Rioux C, Jestin C, Bouvet E, Soulé JC, Leport C, Duval X. Anal squamous intraepithelial lesions and condyloma in HIV-infected heterosexual men, homosexual men and women: prevalence and associated factors. AIDS 2007;21:1457-65.
- O’Mahony C, Gomberg M, Skerlev M, et al. Position statement for the diagnosis and management of anogenital warts. J Eur Acad Dermatol Venereol 2019;33:1006–19.
- Gilson R, Nugent D, Werner R, Ballesteros J, Ross J. 2019 IUSTI‐Europe guideline for the management of anogenital warts. J Eur Acad Dermatol Venereol 2020;34:1644–53.
- Werner RN, Westfechtel L, Dressler C, Nast A. Anogenital warts and other HPV-associated anogenital lesions in the HIV-positive patient: a systematic review and meta-analysis of the efficacy and safety of interventions assessed in controlled clinical trials. Sex Transm Infect 2017;93:543–50.
- Bertolotti A, Ferdynus C, Milpied B, Dupin N, Huiart L, Derancourt C. Local Management of Anogenital Warts in Non-Immunocompromised Adults: A Network Meta-Analysis of Randomized Controlled Trials. Dermatol Ther (Heidelb) 2020;10:249–62.
- Barton S, Wakefield V, O’Mahony C, Edwards S. Effectiveness of topical and ablative therapies in treatment of anogenital warts: a systematic review and network meta-analysis. BMJ Open 2019;9:e027765.
- Bertolotti A, Milpied B, Fouéré S, Dupin N, Cabié A, Derancourt C. Local management of anogenital warts in non-immunocompromised adults: a systematic review and meta-analyses of randomized controlled trials. Dermatol Ther (Heidelb) 2019;9:761–74.
- Garland SM, Sellors JW, Wikstrom A, et al. Imiquimod 5% cream is a safe and effective self-applied treatment for anogenital warts–results of an open-label, multicentre Phase IIIB trial. Int J STD AIDS 2001;12:722–9.
- Gkegkes ID, Iavazzo C, Stamatiadis AP. Intra-anal use of imiquimod: what is the clinical evidence? Int J STD AIDS 2019;30:1018–24.
- Fuertes I, Bastida C, Lopez-Cabezas C, et al. The effectiveness and tolerability of imiquimod suppositories to treat extensive intra-anal high-grade squamous intraepithelial lesions/warts in HIV-infected individuals. Int J STD AIDS 2019;30 :1194-200.
- Schofer H, Van Ophoven A, HenkeU, Lenz T, Eul A. Randomized, comparative trial on the sustained efficacy of topical imiquimod 5% cream versus conventional ablative methods in external anogenital warts. Eur J Dermatol 2006;16:642–8.
- Feng C, Li W, Wang X, Zhang H, Si L, Chen Z, Bai M. A systematic review evaluating the efficacy and safety of a combination of ablative treatment and self administered treatment versus ablative treatment alone for external anogenital warts. Int J Dermatol 2020;59:1210–6.
- Gilson R, Nugent D, Bennett K, et al. Imiquimod versus podophyllotoxin, with and without human papillomavirus vaccine, for anogenital warts: the HIPvac factorial RCT. Southampton (UK): NIHR Journals Library; 2020 Sep. (Health Technology Assessment, No. 24.47.)
- Machalek DA, Poynten M, Jin F, et al. Anal human papillomavirus infection and associated neoplastic lesions in men who have sex with men: a systematic review and meta-analysis. Lancet Oncol 2012;13:487–500.
- Goldstone SE, Johnstone AA, Moshier EL. Long-term outcome of ablation of anal high-grade squamous intraepithelial lesions: recurrence and incidence of cancer. Dis Colon Rectum 2014;57:316–23.
- Wieland U, Brockmeyer NH, Weissenborn SJ, et al. Imiquimod treatment of anal intraepithelial neoplasia in HIV-positive men. Arch Dermatol 2006; 142:1438–44.
- Kreuter A, Wieland U, Gambichler T, et al. p16ink4a expression decreases during imiquimod treatment of anal intraepithelial neoplasia in human immunodeficiency virus-infected men and correlates with the decline of lesional high-risk human papillomavirus DNA load. Br J Dermatol 2007;157:523–30.
- Fox PA, Nathan M, Francis N, et al. A double-blind, randomized controlled trial of the use of imiquimod cream for the treatment of anal canal high-grade anal intraepithelial neoplasia in HIV-positive MSM on HAART, with long-term followup data including the use of open-label imiquimod. AIDS 2010;24:2331–5.
- Richel O, de Vries HJ, van Noesel CJ, Dijkgraaf MG, Prins JM. Comparison of imiquimod, topical fluorouracil, and electrocautery for the treatment of anal intraepithelial neoplasia in HIV-positive men who have sex with men: an open-label, randomised controlled trial. Lancet Oncol 2013;14:346–53.
- Brogden DRL, Walsh U, Pellino G, Kontovounisios C, Tekkis P, Mills SC. Evaluating the efficacy of treatment options for anal intraepithelial neoplasia: a systematic review. Int J Colorectal Dis 2020 Online ahead of print.
Coordonnateur : Lucas Spindler (Paris)
Contributeurs : Perrine Mortreux (Lille), Carine Visée (Marseille), François Pigot (Bordeaux)



